Комплект TIANScriptⅡ RT
Особливості
■ Висока активність ферментів та ефективність: висока активність зворотної транскриптази та хороша сумісність у наступних експериментах.
■ Широкий діапазон субстратів: підходить для всіх РНК, особливо для шаблонів РНК зі складною вторинною структурою.
■ Велика довжина RT: Синтез першої нитки кДНК може досягати 12 кб.
■ Проста операція: Просто додайте необхідні компоненти за один крок без додавання реагенту під час операції.
Додатки
■ Синтез першої нитки кДНК.
■ Побудова бібліотеки кДНК.
■ Одноетапна RT-PCR.
■ Аналіз RACE.
Усі продукти можна налаштувати для ODM/OEM. Для деталей,будь ласка, натисніть Індивідуальне обслуговування (ODM/OEM)
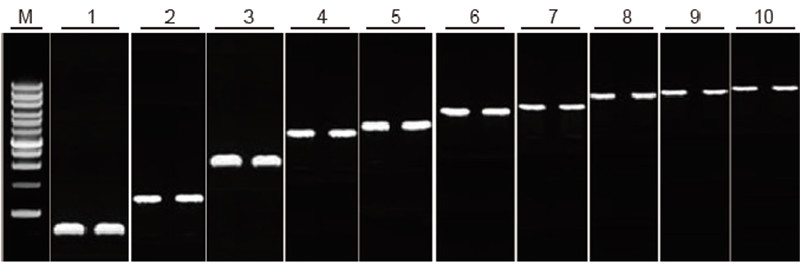 |
Можливість зворотної транскрипції TIANScript II RT Kit для фрагментів різної довжини Метод: Зворотна транскрипція: Зверніться до посібника з експлуатації TIANScript II RT Kit. Результати: Гелеве зображення показує результати ампліфікації 10 генів -мішеней різної довжини після зворотної транскрипції 1 мкг загальної РНК. На одну смугу завантажували 2 мкл продуктів зворотної транскрипції. Система ампліфікації (ПЛР): 20 мкл; Навантаження зразка: 5 мкл; Маркер: D15000+1 кб ДНК -сходи; Концентрація гелю: 1%; Умови електрофорезу: 6 В/см, 20 хв Діаграма кожної смуги руху: М: ДНК -маркер; 1: Довжина виробу: 120 bp; 2: Довжина виробу: 1 кб; 3: Довжина виробу: 2,5 кб; 4: Довжина виробу: 3,2 кб; 5: Продукт довжина: 4,6 кб; 6: Довжина виробу: 6,8 кб; 7: Довжина виробу: 7,6 кб; 8: Довжина виробу: 8,9 кб; 9: Довжина виробу: 10 кб; 10: Довжина виробу: 12 кб; |
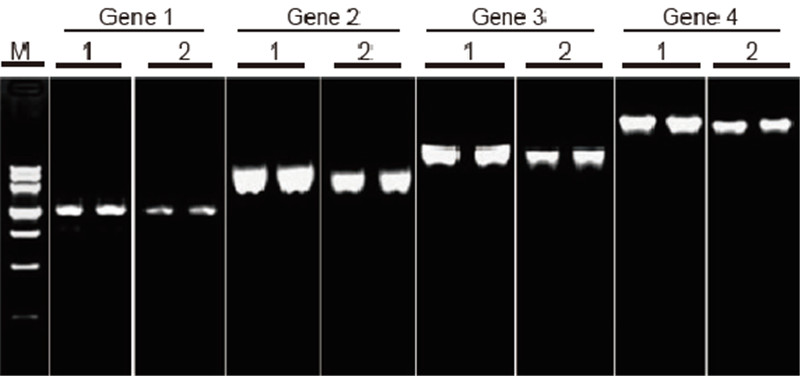 |
Порівняння ефективності та специфічності набору TIANScript II RT та продуктів інших постачальників при зворотній транскрипції довгих шаблонів Матеріали: Загальна РНК адгезивних клітин людини. Початкова кількість RT-PCR: 2 мкл продукту зворотної транскрипції (50 нг/мкл) Метод: зворотна транскрипція: Зверніться до посібника з експлуатації TIANScript II RT Kit. Результати: Гелеве зображення показує результати ампліфікації 6 генів-мішеней з різною довжиною після зворотної транскрипції 1 мкг загальної РНК клітин, прикріплених до людини, за допомогою M-MLV від постачальника A та TIANGEN TIANScript II RT Kit. Система ампліфікації (ПЛР): 20 мкл; Навантаження зразка: 5 мкл; Маркер: ДНК -маркер III; Концентрація гелю: 1%; Умови електрофорезу: 6 В/см, 20 хв. Діаграма кожної смуги руху: М: ДНК -маркер; 1: результати ампліфікації зворотної транскрипції кДНК за допомогою TIANScriptII RT Kit; 2. Результати ампліфікації зворотної транскрипції кДНК з використанням відповідного продукту від Постачальника А. Довжина продукту гена 1 становить 1,3 кб; Довжина продукту гена 2 - 3,0 кб; Довжина продукту гена 3 становить 5,0 кб; Довжина продукту гена 4 становить 7,5 кб. |
Деградує РНК А-1
—— Очистити високоякісну РНК без забруднення. Матеріал, з якого екстрагується РНК, повинен бути максимально свіжим, щоб запобігти деградації РНК. Перед реакцією RT аналізуйте цілісність РНК на денатурованому гелі. Після екстракції РНК її слід зберігати у 100% формаміді. Якщо використовується інгібітор РНКази, температура нагрівання повинна бути <45 ° С, а рН повинен бути меншим за 8,0, інакше інгібітор вивільнить всю зв'язану РНКазу. Крім того, інгібітор РНКази слід додавати у розчини, що містять ≥ 0,8 мМ ДТТ.
РНК А-2 містить інгібітори реакцій зворотної транскрипції
—— Інгібітори зворотної транскрипції включають SDS, EDTA, гліцерин, пірофосфат натрію, спермідин, формамід, гуанідинову сіль тощо. Змішайте контрольну РНК зі зразком та порівняйте вихід з реакцією контрольної РНК, щоб перевірити, чи є інгібітор. Промийте осад РНК 70% (об./Об.) Етанолом для видалення інгібіторів.
А-3 Недостатній відпал праймерів, що використовуються для синтезу першого ланцюга кДНК
—— Визначте, що температура відпалу підходить для праймерів, використаних в експерименті. Для випадкових гексамерів рекомендується підтримувати температуру на рівні 25 ° C протягом 10 хвилин до досягнення температури реакції. Для ген-специфічних праймерів (GSP) спробуйте інший GSP або перейдіть на оліго (dT) або випадковий гексамер.
А-4 Невелика кількість вихідної РНК
—— Збільшення кількості РНК. Для зразків РНК менше 50 нг, 0,1 мкг до 0,5 мкг ацетил BSA можна використовувати в синтезі кДНК першої нитки
А-5 Послідовність мішені не експресується в аналізованих тканинах.
—— Спробуйте інші тканини.
Реакція ПЛР А-6 не дає результату
—— Для двоетапної RT-PCR матриця кДНК на стадії ПЛР не може перевищувати 1/5 об’єму реакції.
А-1 Неспецифічний відпал праймерів та шаблонів
—— 3'-кінці праймерів не повинні містити 2-3 dG або dC. Використовуйте генно-специфічні праймери в синтезі першої нитки замість випадкових праймерів або оліго (dT). У перші кілька циклів використовуйте більш високу температуру відпалу, а потім нижчу температуру відпалу. Для поліпшення специфічності реакції використовуйте ДНК-полімеразу Taq DNA для ПЛР.
A-2 Поганий дизайн ген-специфічних праймерів
—— Дотримуйтесь тих же принципів для дизайну ампліфікації грунтовки.
РНК А-3, забруднена геномною ДНК
—— Обробіть РНК з ДНКазою класу ПЛР. Встановіть контрольну реакцію без зворотної транскрипції для виявлення зараження ДНК.
А-4 Формування грунтового димеру
—— Розробка праймерів без комплементарних послідовностей на 3 'кінці.
А-5 Занадто високий Mg2+ концентрація
—— Оптимізувати Mg2+ концентрація для кожної комбінації шаблону та праймера
A-6 Забруднений чужорідною ДНК
—— Використовуйте аерозолестійкі наконечники та ферменти УДГ.
А-1 Занадто високий вміст продукту першої нитки
—— Зменшіть кількість продукту першої нитки на звичайній стадії реакції ПЛР.
А-2 Занадто велика кількість праймера в реакції ПЛР
——Зменшити введення праймера.
A-3 Занадто багато циклів
—— Оптимізуйте умови реакції ПЛР та зменшіть кількість циклів ПЛР.
A-4 Занадто низька температура відпалу
—— Збільште температуру відпалу, щоб запобігти неспецифічному ініціюванню та продовженню.
А-5 Неспецифічна ампліфікація олігонуклеотидних фрагментів, що утворюються в результаті розпаду ДНКази ДНК--Витягніть високоякісну РНК, щоб запобігти зараженню ДНК.
РТ-ПЛР полягає у зворотній транскрипції РНК в кДНК, а потім у зворотній транскрибованій кДНК як матриці для реакції ПЛР для ампліфікації фрагмента-мішені. Виберіть випадкові праймери, Oligo dT і генно -специфічні праймери відповідно до конкретних умов експерименту. Усі вищевказані праймери можуть бути використані для короткої мРНК еукаріотичних клітин без структури шпильки.
Випадковий праймер: Підходить для довгих РНК зі структурою шпильок, а також для всіх видів РНК, таких як рРНК, мРНК, тРНК тощо. Вони використовуються в основному для реакції RT-PCR одного матриці.
Oligo dT: Підходить для РНК з хвостами PolyA (прокаріотична РНК, еукаріотична рТНК Oligo dT та тРНК не мають хвостів PolyA). Оскільки Oligo dT зв’язаний з хвостом PolyA, якість зразків РНК має бути високою, і навіть невелика кількість деградації значно зменшить кількість повнорозмірного синтезу кДНК.
Генно-специфічний праймер: Доповнює послідовність шаблонів, підходить для ситуацій, коли цільова послідовність відома.
Є два шляхи:
1. Внутрішній еталонний метод: теоретично кДНК - це фрагменти ДНК різної довжини, тому результатом електрофорезу є мазок. Якщо кількість РНК низька, жоден продукт не виявиться в електрофорезі, але це не означає, що жоден продукт не буде ампліфікований за допомогою ПЛР. Взагалі, для виявлення кДНК можна використати внутрішнє посилання. Якщо внутрішні посилання мають результати, якість кДНК може бути в основному гарантована (у деяких випадках, якщо фрагмент гена -мішені занадто довгий, можуть бути винятки).
2. Якщо є відомий ген, ампліфікований цим шаблоном, це можна перевірити праймерами цього гена. Посилення внутрішнього посилання не обов'язково означає, що з кДНК немає проблем. Оскільки внутрішнє посилання має велику кількість кДНК, його легко підсилити. Якщо кДНК частково деградується з різних причин, з точки зору ймовірності, результати ПЛР генів -мішеней з низьким вмістом значною мірою зазнають впливу. В той час як внутрішні посилання все ще мають велику кількість, на посилення це, ймовірно, не вплине.
Частково деградує РНК. Виявити цілісність і очистити РНК
Вміст РНК у різних видів може бути різним, але загалом вилучена загальна РНК повинна містити дві чіткі смуги 28S і 18S в електрофорезі гелем, а яскравість першої смуги повинна бути вдвічі вищою, ніж у другої. Смуга 5S вказує на те, що РНК деградувала, а її яскравість пропорційна ступеню деградації. Успішна ампліфікація внутрішньої референції не означає, що з РНК немає проблем, оскільки внутрішня референція у великій кількості, РНК можна підсилювати, поки деградація не є сильною. ОД260/ОД280Співвідношення чистої РНК, виміряне спектрофотометром, повинно бути між 1,9 і 2,1. Невелика кількість домішок білка в РНК зменшить співвідношення. До тих пір, поки значення не буде занадто низьким, на РТ це не вплине. Найважливіше для РТ - це цілісність РНК.
Розширення внутрішнього референтного гена може вказувати лише на те, що RT вдалося, але це не обов’язково пов’язано з якістю ланцюга кДНК. Оскільки внутрішні еталонні фрагменти, як правило, мають невеликі розміри та високу експресію, їм легше досягти успіху у зворотній транскрипції. Однак розмір і експресія гена -мішені варіюються від гена до гена. Якість кДНК не можна оцінювати лише за внутрішнім посиланням, особливо для цільових фрагментів довжиною більше 2 кб.
Деякі зразки мають складну вторинну структуру, або мають багатий вміст ГХ, або дорогоцінні з невеликою кількістю. У цих випадках слід обрати відповідну зворотну транскриптазу відповідно до розміру цільового фрагмента та зразка. Для шаблонів РНК з високим вмістом ГХ і складною вторинною структурою важко відкрити вторинну структуру при низькій температурі або за допомогою загальної зворотної транскриптази. Для цих шаблонів можна вибрати квантову зворотну транскриптазу, оскільки її ефективність зворотної транскрипції очевидно краща, ніж у зворотної транскриптази серії M-MLV, яка може ефективно зворотно транскрибувати різні шаблони РНК і максимально транскрибувати РНК у першу ланцюг кДНК. При використанні загального набору зворотної транскриптази система з 20 мкл може ефективно ефективно зворотно транскрибувати 1 мкг загальної РНК. Будь ласка, зверніть увагу на максимальну потужність RT комплекту. Якщо шаблон додається надмірно, зворотна транскрипція сприятиме РНК з великою кількістю. Тому краще не перевищувати максимальну потужність системи.
A-1 Визначте, чи сильно РНК погіршується, і чи успішна RT
Загалом, причина невдач внутрішнього еталонного підсилення часто викликана серйозною деградацією РНК. Інша можлива причина - помилка зворотної транскрипції. Внутрішнє посилання не може бути використане як стандарт для оцінки якості одноланцюгової кДНК, але воно може бути використано як стандарт для оцінки того, чи є зворотна транскрипція успішною, якщо немає проблем з якістю РНК. Найважливіше в процесі зворотної транскрипції - підтримувати постійну температуру та постійну реакційну систему, щоб покращити ефективність реакції.
А-2 Визначте, чи праймери для ампліфікації внутрішніх референтних генів надійні, і чи є проблеми з реагентами, що використовуються в ПЛР.
Для відносного кількісного визначення РНК необхідно кількісно визначити перед зворотною транскрипцією, що також потрібно у багатьох наборах зворотної транскрипції, наприклад, кількісно оцінити вхідну РНК як 1 мкг. Оскільки зворотно транскрибована кДНК є змішаним розчином, що включає РНК, оліго dT, фермент, dNTP і навіть невелику кількість залишку ДНК, це спричинить відхилення, тому неможливо точно визначити кількісну кількість кДНК. Тому необхідна кількісна оцінка РНК. Враховуючи, що ефективність зворотної транскрипції однакова серед різних зразків, кількість отриманої кДНК має бути однаковою, а кількісний аналіз може показати порівняння рівнів експресії різних генів в однаковій кількості загальної РНК. При проведенні відносної флуоресцентної кількісної ПЛР кількісна кДНК може не знадобитися після зворотної транскрипції, оскільки внутрішній референтний ген може діяти як еталонний.
В основному це пов'язано з генами, і зворотна транскрипція довгих фрагментів неможлива для більшості генів. По -перше, ефективність зворотної транскрипції набагато нижча, ніж ефективність ПЛР. По -друге, багата на ГХ область та вторинна структура багатьох генів обмежують як зворотну транскрипцію, так і ПЛР. Нарешті, вірність та ефективність ампліфікації ПЛР важко гарантувати одночасно. У процесі зворотної транскрипції ніхто не може гарантувати отримання довгих фрагментів для генів з низькою копією, особливо з використанням оліго dT. Щодо 5 'UTR з більшою кількістю ГХ, це ще складніше. Тому все ще є розумним методом скасувати транскрипцію за допомогою випадкових праймерів, знайти природні ділянки розщеплення у цільовому фрагменті, ампліфікувати за сегментами, а потім виконати рестрикційне травлення та лігування. Загалом, важко безпосередньо ампліфікувати фрагменти розміром більше 2 кб, але не завжди неможливо отримати: 1. По -перше, гарантуйте цілісність РНК/мРНК, і переважною є екстракція ТРИЗОЛУ. 2. Набір M-MLV RT-PCR можна безпосередньо використовувати. Подовжте час відпалу та належним чином збільште кількість циклів у процесі ампліфікації. Альтернативно, можна застосувати вкладену ПЛР або спочатку провести одну або дві реакції з належним чином збільшеним часом денатурації та продовження до нормальної ПЛР -ампліфікації, що може допомогти розширити фрагменти. Зверніть увагу на вірність полімерази. 3. Довгий Taq можна використовувати в ПЛР для отримання ідеальних результатів. 4. Для застосування експресії білка слід застосовувати високоточну полімеразу.
TIANGEN пропонує два види зворотної транскриптази: Quant/King RTase та TIANScript M-MLV. Основна відмінність між ними - це кількість введених шаблонів. Quant-це унікальна зворотна транскриптаза, яка відрізняється від загальновживаної M-MLV, похідної від вірусу мишачого лейкозу Moloney. Quant-це нова високоефективна зворотна транскриптаза, рекомбінантно експресована інженерною кишковою паличкою. Quant підходить для ампліфікації 50 нг-2 мкг РНК з високою зворотною транскрипційною активністю та високим виходом. Порівняно зі звичайними MMLV або AMV, найбільшою характеристикою Quant є те, що він має дуже сильну спорідненість з шаблонами РНК і може змінити складні шаблони транскрипції без високої температури денатурації. Для шаблонів з більшим вмістом GC, зворотна ефективність вища. Однак ця зворотна транскриптаза має активність РНКази Н, яка може впливати на довжину продукту кДНК (підходить для шаблонів <4,5 кб). Для звичайної зворотної транскрипції рекомендується зворотна транскриптаза TIANScript MMLV. Ця РТаза являє собою модифікований фермент з дуже слабкою активністю РНКази Н, який підходить для тривалого (> 5 кб) синтезу кДНК.
Одноетапна зворотна транскрипція та ампліфікація ПЛР завершуються в одній пробірці, не відкриваючи кришки трубки між синтезом і ампліфікацією кДНК, що допомагає зменшити забруднення. Оскільки всі отримані зразки кДНК використовуються для ампліфікації, чутливість є вищою - мінімум 0,01 пг загальної РНК. Для успішного одноетапного RTPCR ген-специфічні праймери зазвичай використовуються для ініціації синтезу кДНК. Двоетапний метод, а саме зворотна транскрипція та ампліфікація ПЛР, здійснюють у два етапи. Спочатку здійснюють зворотну транскрипцію з матриці РНК для отримання кДНК, а отриману кДНК піддають одній або декільком різним реакціям ПЛР. Двоетапний метод може використовувати оліго (dT) або випадкові праймери для керування синтезом першого ланцюга кДНК і може зворотно транскрибувати всю інформацію мРНК з конкретного зразка.
Категорії товарів
ЧОМУ ВИБРАТИ НАС
З моменту свого заснування наша фабрика розробляє першокласну продукцію з дотриманням принципу
якість насамперед. Наші вироби завоювали чудову репутацію в галузі та цінні довіри серед нових і старих клієнтів.








