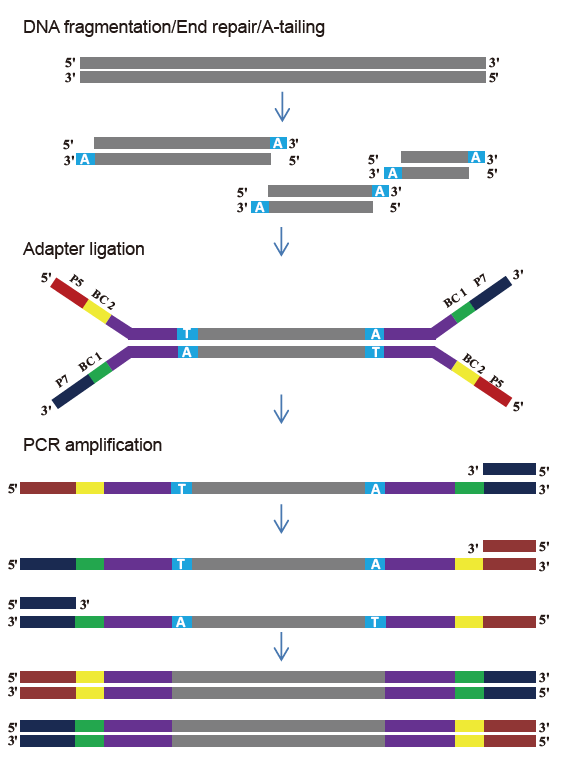
Бібліотечний комплект TIANSeq DirectFast (підсвічування)
Особливості
■ Хороша однорідність секвенування: відсутність зміщення базису процесу фрагментації ДНК та процесу ампліфікації ПЛР.
■ Висока ефективність перетворення бібліотек: високоефективну конструкцію бібліотеки можна забезпечити для зразків ДНК 1 нг.
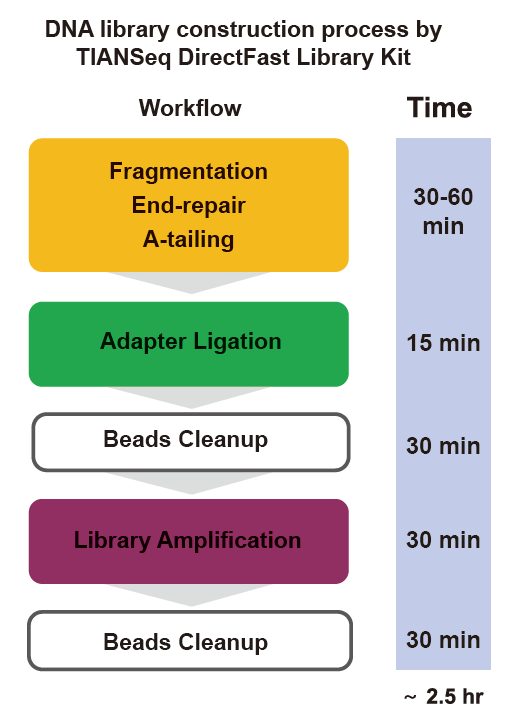
■ Швидка робота: Весь процес побудови бібліотеки займає всього 2,5 години.
■ Економічно ефективний: не потрібні спеціальні інструменти та обладнання。
Специфікація
Тип: Підготовка бібліотеки ДНК для високопродуктивної платформи секвенування illumina
Зразок: Геномна ДНК або ДНК з великим фрагментом
Ціль: Дволанцюгова ДНК
Початковий зразок введення: 1 нг- 1 мкг
Час роботи: 2,5 години
Нижчі потоки програм: Послідовність на платформі illumina
Усі продукти можна налаштувати для ODM/OEM. Для деталей,будь ласка, натисніть Індивідуальне обслуговування (ODM/OEM)
Гнучкий зразок введення та фрагментований розмір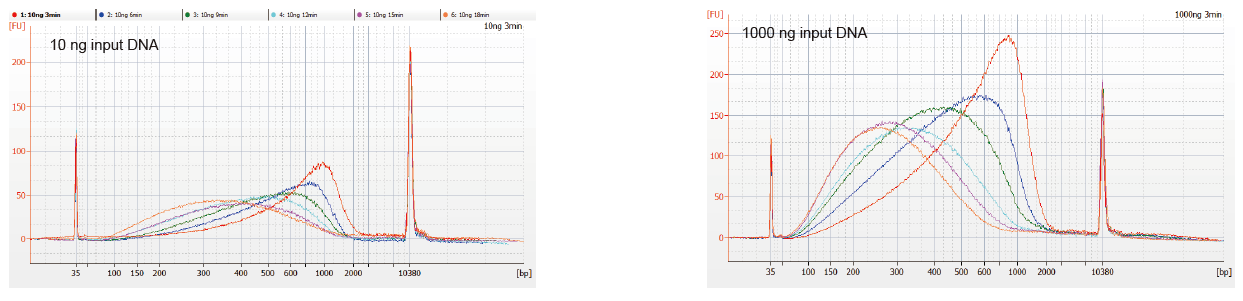 |
Малюнок 1. Профілі фрагментації ДНК різного часу реакції. ДНК 10 нг та 1000 нг фрагментували за допомогою TIANSeq DirectFast Library Library Kit. Продукти реакції, оброблені з різним часом реакції, очищали магнітними кульками 1,8 × Ampure XP та аналізували за допомогою Angilent 2100. |
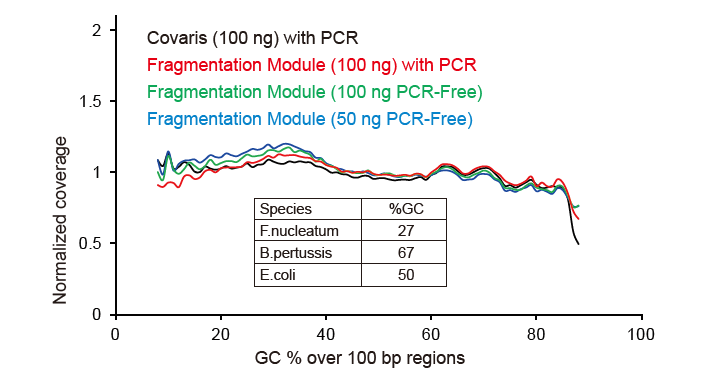
Покриття секвенування, подібне до Covaris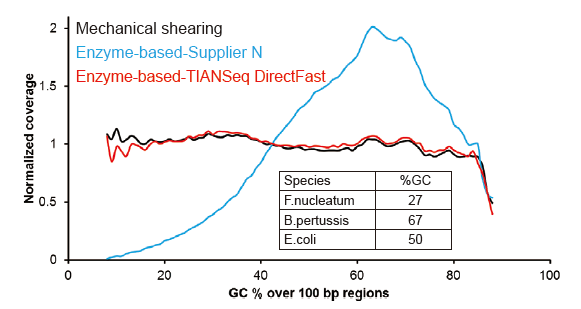 |
Малюнок 2. Порівняння охоплення геному різними методами підготовки бібліотек. Три геномні ДНК бактерій з різним вмістом ГХ змішують еквімолярно, і порівняли результат охоплення генома 100 нг змішаних бібліотек ДНК за допомогою цих методів. Результати показують, що бібліотечний комплект TIANSeq DirectFast має такий самий вплив на фрагментацію ДНК, що і механічне зсув, і немає базового ухилу для фрагментації. |
Немає систематичного зсуву для вхідної ДНК на 1 нг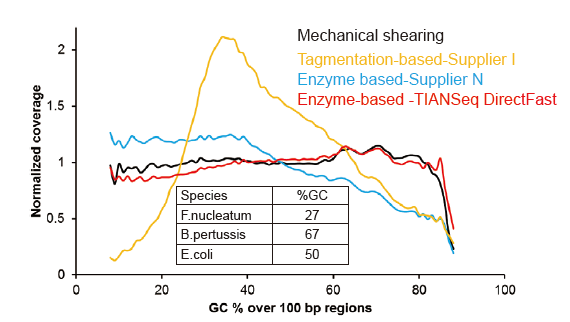 |
Малюнок 3. Порівняння охоплення геному різними методами підготовки бібліотек. Три геномні ДНК бактерій з різним вмістом ГХ змішують еквімолярно, і порівняли результат покриття генома секвенування 1 нг змішаних бібліотек ДНК за допомогою цих методів. Результати показують, що бібліотечний набір TIANSeq DirectFast має послідовний ефект фрагментації з механічним зсувом навіть для введення ДНК всього за 1 нг, і немає зміщення бази. |
| Можливість робочого процесу без ПЛР
|
Малюнок 4. Різні вхідні дані геномної ДНК були використані для побудови бібліотеки методом ПЛР або без ПЛР-бібліотеки, а також порівняно результати охоплення геному. Результати показують, що завдяки роботі з однією трубкою та ефективним етапам побудови бібліотеки бібліотека ДНК, побудована за допомогою бібліотечного набору TIANSeq DirectFast, підтримує високу узгодженість з механічним зсувом у розподілі покриття послідовностей фрагментів для обох робочих процесів, збагачених ПЛР. |
Статистика ефективності та врожайності бібліотек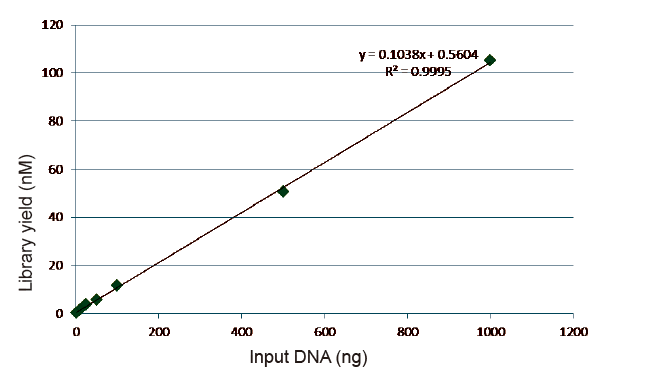 |
Малюнок 5. Результати кількісного аналізу бібліотечної ДНК, отриманої за допомогою qPCR після побудови бібліотеки методом без ПЛР, для зразків з різною вихідною кількістю (1, 10, 25, 50, 100, 500, 1000 нг). Лінійно -регресійний аналіз показує, що вихід бібліотеки має хороші лінійні співвідношення в широкому діапазоні вхідних даних. Для введення ДНК до 1 нг ефективність побудови бібліотеки не зменшується. |
Порівняння даних секвенування різних продуктів
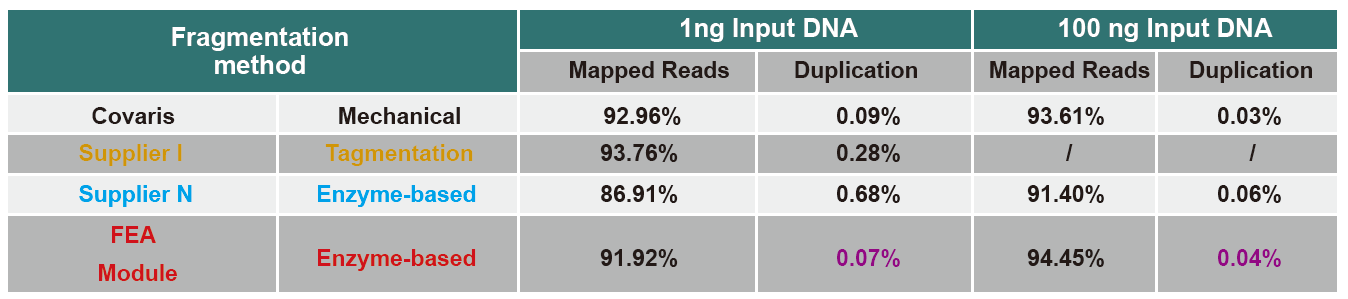
В даний час високопродуктивна технологія секвенування в основному базується на технології секвенування нового покоління. Оскільки довжина читання технології послідовності наступного покоління обмежена, ми повинні розділити послідовність повної довжини на невеликі бібліотеки фрагментів для послідовності. Відповідно до потреб різних експериментів з секвенуванням, ми зазвичай обираємо одностороннє або двостороннє. В даний час фрагменти ДНК бібліотеки секвенування наступного покоління зазвичай розподіляються в діапазоні 200-800 п.н.

а) ДНК поганої якості та містить інгібітори. Використовуйте високоякісні зразки ДНК, щоб уникнути пригнічення активності ферментів.
б) Кількість зразка ДНК недостатня при використанні методу без ПЛР для побудови бібліотеки ДНК. Коли вхід фрагментованої ДНК перевищує 50 нг, робочий процес без ПЛР може бути вибірково здійснений під час процесу побудови бібліотеки. Якщо номер копії бібліотеки занадто низький, щоб її можна було безпосередньо секвенувати, бібліотеку ДНК можна ампліфікувати за допомогою ПЛР після лігування адаптера.
в) Забруднення РНК призводить до неточної початкової кількісної оцінки ДНК Забруднення РНК може існувати в процесі очищення геномної ДНК, що може призвести до неточної кількісної оцінки ДНК та недостатнього завантаження ДНК під час побудови бібліотеки. РНК можна видалити шляхом обробки РНКазою.
А-1
а) З'являються невеликі фрагменти (60 п.н.-120 п.н.). Очищення за допомогою магнітних кульок Agencourt AMPure XP може ефективно видалити ці фрагменти адаптера та забезпечити якість послідовності.
б) Великі фрагменти з'являються в бібліотеці після ампліфікації ПЛР. Розмір бібліотечного фрагмента ДНК збільшиться на 120 п.н. після лігування адаптера. Якщо фрагмент ДНК збільшується більш ніж на 120 п.н. після перев'язки адаптера, це може бути викликано аномальною ампліфікацією фрагмента надмірною ампліфікацією ПЛР. Зменшення кількості циклів ПЛР може запобігти ситуації.
c) Аномальний розмір бібліотечних фрагментів ДНК після лігування адаптера Довжина адаптера в цьому наборі становить 60 п.н. Коли два кінці фрагмента будуть перев’язані до адаптерів, довжина збільшиться лише на 120 п.н. Якщо ви використовуєте адаптер, відмінний від того, що надається цим набором, зверніться до постачальника, щоб надати відповідну інформацію, таку як довжина адаптера. Будь ласка, переконайтеся, що робочий процес та робота експерименту відповідають крокам, описаним у посібнику.
d) Аномальний розмір фрагмента ДНК до перев'язки адаптера Причиною цієї проблеми можуть бути неправильні умови реакції під час фрагментації ДНК. Для різного введення ДНК слід використовувати різний час реакції. Якщо вхід ДНК перевищує 10 нг, ми рекомендуємо вибрати час реакції 12 хвилин як час початку оптимізації, а розмір фрагмента, отриманого в цей час, знаходиться переважно в діапазоні 300-500 п.н. Користувачі можуть збільшувати або зменшувати довжину фрагментів ДНК протягом 2-4 хв відповідно до власних вимог для оптимізації фрагментів ДНК з необхідним розміром.
А-2
а) Час фрагментації не оптимізовано Якщо фрагментована ДНК занадто мала або занадто велика, будь ласка, зверніться до Настанов щодо вибору часу фрагментації, наданих в інструкції, щоб визначити час реакції, і використовуйте цей момент часу як контроль, додатково встановіть реакційну систему, щоб подовжити або скоротити 3 хвилини для більш точного регулювання часу фрагментації.
А-3
Аномальний розподіл ДНК за розміром після обробки фрагментацією
а) Неправильний метод розморожування реагенту дроблення, або реагент не повністю перемішується після розморожування. Розморозьте 5 -кратний реагент для фрагментації ферментної суміші на льоду. Після розморожування рівномірно перемішайте реагент, обережно натискаючи дно пробірки. Не вихровуйте реагент!
б) Вхідний зразок ДНК містить ЕДТА або інші забруднювачі. Виснаження іонів солі та хелатуючих агентів на етапі очищення ДНК особливо важливо для успіху експерименту. Якщо ДНК розчиняється в 1 × TE, використовуйте метод, наведений в інструкції, для фрагментації. Якщо концентрація ЕДТА в розчині невизначена, рекомендується очистити ДНК і розчинити її в деіонізованій воді для подальшої реакції.
в) Неточне початкове кількісне визначення ДНК Розмір фрагментованої ДНК тісно пов'язаний з кількістю введеної ДНК. Перед обробкою фрагментацією для визначення точної кількості ДНК в реакційній системі необхідна точна кількісна оцінка ДНК за допомогою Qubit, Picogreen та інших методів.
d) Підготовка реакційної системи не відповідає інструкціям. Підготовку фрагментованої реакційної системи слід проводити на льоду строго відповідно до інструкцій. Для забезпечення найкращого ефекту всі компоненти реакції слід покласти на лід і підготувати реакційну систему після повного охолодження. Після завершення підготовки, будь ласка, проведіть пальцем або піпеткою, щоб ретельно перемішати. Не вихровіть!
1. Неправильний метод змішування (вихровий, сильні коливання тощо) спричинить аномальний розподіл фрагментів бібліотеки (як показано на наступному малюнку), що вплине на якість бібліотеки. Тому, готуючи реакційний розчин Fragmentation Mix, будь ласка, акуратно піпетуйте вгору і вниз, щоб перемішати, або використовуйте кінчик пальця, щоб гортати і рівномірно перемішувати. Будьте обережні, щоб не змішати з вихором.

2. Для побудови бібліотеки необхідно використовувати ДНК високої чистоти
■ Хороша цілісність ДНК: діапазон електрофорезу становить більше 30 кб, без хвостів
■ OD260/230:> 1.5
■ OD260/280: 1,7-1,9
3. Кількість введеної ДНК має бути точною. Для кількісної оцінки ДНК пропонується використовувати методи Qubit та PicoGreen, а не Nanodrop.
4. Необхідно визначити вміст ЕДТА у розчині ДНК. ЕДТА має великий вплив на реакцію фрагментації. Якщо вміст ЕДТА високий, перед наступним тестом необхідно провести очищення ДНК.
5. Розчин реакції дроблення необхідно готувати на льоду. Процес дроблення чутливий до температури та часу реакції (особливо після додавання підсилювача). Щоб забезпечити точність часу реакції, підготуйте реакційну систему на льоду.
6. Час реакції фрагментації повинен бути точним. Час реакції на етапі фрагментації безпосередньо впливатиме на розмір продуктів -фрагментів, тим самим впливаючи на розподіл розмірів фрагментів ДНК у бібліотеці.
1. Який тип зразка застосовується до цього набору?
Відповідним типом зразка цього набору може бути загальна РНК або очищена мРНК з хорошою цілісністю РНК. Якщо для побудови бібліотеки використовується загальна РНК, для видалення рРНК спочатку рекомендується використовувати комплект для виснаження рРНК (Cat#4992363/4992364/4992391).
2. Чи можна використати зразки FFPE для створення бібліотеки за допомогою цього набору?
МРНК у зразках FFPE буде деградувати до певної міри з відносно поганою цілісністю. При використанні цього набору для побудови бібліотеки рекомендується оптимізувати час фрагментації (скоротити час фрагментації або не виконувати фрагментацію).
3. З огляду на крок вибору розміру, наведений у посібнику з виробу, що може спричинити незначне відхилення вставленого сегмента?
Вибір розміру повинен здійснюватись у суворій відповідності з кроком вибору розміру в цьому посібнику з виробу. Якщо є відхилення, причина може полягати в тому, що магнітні намистинки не збалансовані до кімнатної температури або не змішані повністю, піпетка не точна або рідина залишилася в наконечнику. Для експерименту рекомендується використовувати наконечники з низькою адсорбцією.
4. Вибір адаптерів у будівництві бібліотек
Конструкторський комплект бібліотеки не містить реагента-адаптера, і рекомендується використовувати цей комплект разом з адаптером TIANSeq з одним індексом (Illumina) (4992641/4992642/4992378).
5. КК бібліотеки
Кількісне виявлення бібліотеки: Qubit і qPCR використовуються для визначення масової концентрації та молярної концентрації бібліотеки відповідно. Операція суворо відповідає інструкції до виробу. Концентрація бібліотеки, як правило, відповідає вимогам секвенування NGS. Виявлення діапазону розповсюдження бібліотек: Використання біоаналізатора Agilent 2100 для виявлення діапазону розповсюдження бібліотек.
6. Вибір номера циклу підсилення
Відповідно до інструкцій, кількість ПЛР-циклів становить 6-12, а кількість необхідних ПЛР-циклів слід вибирати відповідно до введеного зразка. У високопродуктивних бібліотеках перевищення зазвичай відбувається в різному ступені, що проявляється дещо більшим піком після піку цільового діапазону при виявленні біоаналізатора Agilent 2100, або виявлена концентрація Qubit нижче, ніж у qPCR. Помірне надмірне посилення - це нормальне явище, яке не впливає на послідовність бібліотек та подальший аналіз даних.
7. Спайки з'являються в профілі виявлення біоаналізатора Agilent 2100
Поява спайків у виявленні біоаналізатора Agilent 2100 пояснюється нерівномірною фрагментацією зразків, де буде більше фрагментів певного розміру, і це стане більш очевидним після збагачення ПЛР. У цьому випадку пропонується не виконувати вибір розміру, тобто встановити умову фрагментації на 94 ° C протягом 15 хвилин інкубування, де розподіл фрагментів невеликий і концентрований, а однорідність можна покращити.
Категорії товарів
ЧОМУ ВИБРАТИ НАС
З моменту свого заснування наша фабрика розробляє першокласну продукцію з дотриманням принципу
якість насамперед. Наші вироби завоювали чудову репутацію в галузі та цінні довіри серед нових і старих клієнтів.