2 × Taq PCR MasterMix Ⅱ
Особливості
■ Висока ефективність ампліфікації: фрагменти ДНК різного розміру (менше 5 кб) та джерела можна ефективно ампліфікувати.
■ Висока чутливість: За допомогою геномних шаблонів можна підсилити лише 10 пг цільових фрагментів.
■ Висока стійкість до стресу: Для шаблонів з високим вмістом домішок, таких як шаблон для грубого вилучення/бактеріальна культура, цільовий фрагмент можна легко ампліфікувати. Багаторазове заморожування та розморожування не впливає на активність полімерази.
■ Зручний для застосування: Реакційну систему було підготовлено легко і швидко. Ампліфікований фрагмент містить 3'-кінцевий dA-звис, що зручно для клонування ТА.
Специфікація
Тип: Taq ДНК -полімераза
Зразок: Очищений/грубо вилучений шаблон/бактеріальна культура
Шаблон: > 10 стор
Розмір фрагмента: <5 кб
Застосування: ПЛР-ампліфікація фрагментів ДНК, маркування ДНК, розширення праймера, визначення послідовностей, масштабне виявлення генів, напівкількісні експерименти ПЛР, виявлення слідів ДНК тощо.
Усі продукти можна налаштувати для ODM/OEM. Для деталей,будь ласка, натисніть Індивідуальне обслуговування (ODM/OEM)
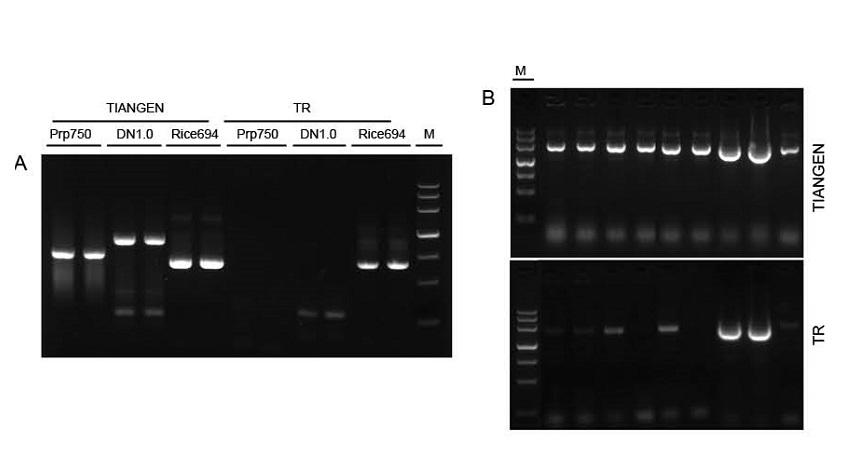 |
Малюнок 1. Шаблони з різних джерел були підсилені за допомогою TIANGEN Taq MasterMix II та загальної суміші Taq від постачальника TR відповідно для виявлення стійкості реагентів до стресу. Результати показують, що продукти TIANGEN можуть ампліфікувати цільові фрагменти із сирих геномних шаблонів та бактеріальної культури, а стійкість до стресу краща, ніж у постачальника TR. В: Сирий геномний шаблон, вилучений набором ПЛР TYANGEN TIANcombi DNA Lyse & Det. Prp/DN: груба екстракція та виявлення зразків крові людини. Рис: Видобуток сировини та виявлення зразків рису. В: ПЛР колонії. ПЛР -фрагмент становить 700 п.н. M: Маркер TIANGEN III |
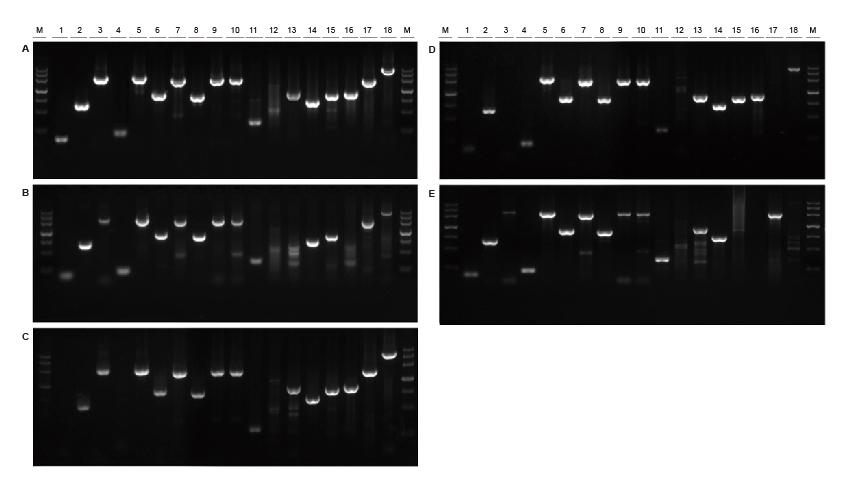 |
Хороша універсальність для шаблонів з різних джерел і різної довжини Малюнок 2. Фрагменти різних джерел та довжини були підсилені за допомогою TIANGEN Taq MasterMix II (A) і звичайний Taq Суміш постачальника TK (B), постачальника TR (C), постачальника V (D) та постачальника G (E) відповідно. Результати показують, що всебічна продуктивність продуктів TIANGEN є найкращою з точки зору можливостей ампліфікації, специфічності та універсальності. 2-3: матриця геномної ДНК-матриці (694 б.п., 2258 п.н.); 4: макет геномної ДНК бавовни (200 п.н.); 5: кишкова паличка матриця геномної ДНК (2298 п.н.); 6-7: ДНК-матриця геному миші (1 кб, 2 кб); 8-10: Геномна матриця ДНК щурів (1 кб, 2 кб, 2080 п.н.); 11-18: ДНК-матриця геному людини (300 б.п., 448 б.п. (GC%: 74,8%), 1100 б.п., 750 б.п., 1000 bp, 1090 bp (GC%: 70,4%), 2 kb, 4 kb) |
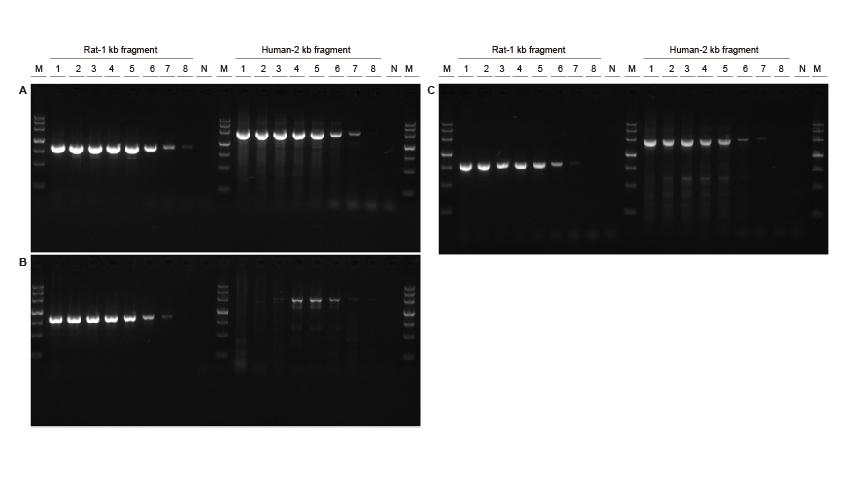 |
Висока чутливість Малюнок 3. Різні концентрації фрагментів ДНК щурів та людини були ампліфіковані за допомогою TIANGEN Taq MasterMix II (A), звичайний Taq Суміш постачальника V (B) та постачальника TK (C) відповідно для виявлення чутливості підсилення. Результати показують, що продукт TIANGEN міг ампліфікувати цільовий фрагмент із шаблону геному на рівні 0,01 нг, а його чутливість краща, ніж у продуктів від Постачальника V та TK.M: TIANGEN Marker III, N: NTCTemplate input 1-8 : 200 нг, 100 нг, 50 нг, 20 нг, 10 нг, 1 нг, 0,1 нг, 0,01 нг. |
Шаблон А-1
■ Шаблон містить білкові домішки або інгібітори Taq тощо. - Очистіть матрицю ДНК, видаліть білкові домішки або витягніть матричну ДНК за допомогою наборів для очищення.
■ Денатурація шаблону не завершена - - належним чином збільшіть температуру денатурації та подовжте час денатурації.
■ Деградація шаблону-повторно підготуйте шаблон.
Буквар А-2
■ Погана якість грунтовки-повторно синтезуйте грунтовку.
■ Деградація грунтовки —— Розріжте грунтовки з високою концентрацією на невеликий об’єм для збереження. Уникайте багаторазового заморожування та розморожування або тривалого кріоконсервування при 4 ° C.
■ Неправильна конструкція грунтовки (наприклад, довжина ґрунтовки недостатня, димер утворений між праймерами тощо)
А-3 мг2+концентрація
■ Mg2+ концентрація занадто низька —— Правильно збільшити Mg2+ концентрація: Оптимізуйте Mg2+ концентрації шляхом серії реакцій від 1 мМ до 3 мМ з інтервалом 0,5 мМ для визначення оптимального Mg2+ концентрація для кожного шаблону та праймера.
A-4 Температура відпалу
■ Висока температура відпалу впливає на зв'язування ґрунтовки та шаблону. —— Зменшіть температуру відпалу та оптимізуйте стан з градієнтом 2 ° C.
А-5 Час продовження
■ Короткий час подовження —— Збільште час подовження.
Явища: Негативні зразки також показують смуги цільової послідовності.
A-1 Забруднення ПЛР
■ Перехресне забруднення послідовності мішеней або продуктів ампліфікації —— Обережно, щоб не пропустити піпеткою зразок, що містить послідовність мішені, у негативній пробі або вилити їх з пробірки для центрифуги. Реактиви або обладнання слід автоклавувати для усунення наявних нуклеїнових кислот, а наявність забруднення слід визначити шляхом експериментів з негативним контролем.
■ Забруднення реагентів —— Розподіліть реактиви рівною мірою та зберігайте при низькій температурі.
А-2 Праймr
■ Mg2+ концентрація занадто низька —— Правильно збільшити Mg2+ концентрація: Оптимізуйте Mg2+ концентрації шляхом серії реакцій від 1 мМ до 3 мМ з інтервалом 0,5 мМ для визначення оптимального Mg2+ концентрація для кожного шаблону та праймера.
■ Неправильний дизайн праймера, а цільова послідовність має гомологію з нецільовою послідовністю. —— Грунтовки для повторного проектування.
Явища: смуги ампліфікації ПЛР не відповідають очікуваному розміру, або великі, або малі, або іноді зустрічаються як специфічні смуги ампліфікації, так і неспецифічні смуги ампліфікації.
Буквар А-1
■ Погана специфічність ґрунтовки
—— Грунтовка для повторного дизайну.
■ Концентрація ґрунтовки занадто висока —— Правильно збільшуйте температуру денатурації та подовжуйте час денатурації.
А-2 мг2+ концентрація
■ Mg2+ концентрація надто висока —— Правильно зменшіть концентрацію Mg2+: Оптимізуйте Mg2+ концентрації шляхом серії реакцій від 1 мМ до 3 мМ з інтервалом 0,5 мМ для визначення оптимального Mg2+ концентрація для кожного шаблону та праймера.
А-3 Термостабільна полімераза
■ Надмірна кількість ферменту - відповідно зменшуйте кількість ферменту з інтервалом 0,5 ОД.
A-4 Температура відпалу
■ Температура відпалу занадто низька —— Відповідно збільште температуру відпалу або застосуйте двоступеневий метод відпалу
А-5 ПЛР цикли
■ Занадто багато циклів ПЛР —— Зменшіть кількість циклів ПЛР.
Буквар А-1—— Погана специфічність —— Переробити грунтовку заново, змінити положення та довжину ґрунтовки, щоб підвищити її специфічність; або виконати вкладену ПЛР.
А-2 шаблонна ДНК
—— Шаблон не чистий —— Очистіть шаблон або витягніть ДНК наборами для очищення.
А-3 мг2+ концентрація
——Мг2+ концентрація занадто висока - належним чином зменшіть Mg2+ концентрація: Оптимізуйте Mg2+ концентрації шляхом серії реакцій від 1 мМ до 3 мМ з інтервалом 0,5 мМ для визначення оптимального Mg2+ концентрація для кожного шаблону та праймера.
A-4 dNTP
—— Концентрація dNTP занадто висока —— Відповідно зменшіть концентрацію dNTP
А-5 Температура відпалу
—— Занадто низька температура відпалу —— Відповідно збільште температуру відпалу
Цикли А-6
—— Занадто багато циклів ——Оптимізуйте номер циклу

Перший крок - вибір відповідної полімерази. Звичайна Taq-полімераза не може коректуватися через відсутність 3'-5 'екзонуклеазної активності, а невідповідність значно знизить ефективність розширення фрагментів. Тому звичайна Taq -полімераза не може ефективно ампліфікувати фрагменти -мішені розміром більше 5 кб. Для поліпшення ефективності розширення та задоволення потреб ампліфікації з довгими фрагментами слід вибрати полімеразу Taq зі спеціальною модифікацією або іншу високоточну полімеразу. Крім того, ампліфікація довгих фрагментів також вимагає відповідного коригування дизайну грунтовки, часу денатурації, часу розширення, рН буфера тощо. Зазвичай праймери з 18-24 п.н. можуть призвести до кращого врожаю. Щоб запобігти пошкодженню шаблону, час денатурації при 94 ° C слід скоротити до 30 секунд або менше за цикл, а час підвищення температури до 94 ° C перед ампліфікацією - менше 1 хвилини. Крім того, встановлення температури розширення приблизно на 68 ° C та розрахунок часу розширення відповідно до швидкості 1 кб/хв може забезпечити ефективне ампліфікацію довгих фрагментів.
Частоту помилок ампліфікації ПЛР можна зменшити, використовуючи різні ДНК -полімерази з високою точністю. Серед усіх виявлених на сьогодні ДНК -полімераз Taq фермент Pfu має найнижчу частоту помилок і найвищу точність (див. Додану таблицю). На додаток до відбору ферментів, дослідники можуть додатково зменшити швидкість мутації ПЛР шляхом оптимізації умов реакції, включаючи оптимізацію складу буфера, концентрацію термостабільної полімерази та оптимізацію числа циклів ПЛР.
Категорії товарів
ЧОМУ ВИБРАТИ НАС
З моменту свого заснування наша фабрика розробляє першокласну продукцію з дотриманням принципу
якість насамперед. Наші вироби завоювали чудову репутацію в галузі та цінні довіри серед нових і старих клієнтів.








